Nepoznati periodni sustav 3. dio
sadržaj
Posljednja epizoda članka o periodnom sustavu, osim školskog (odgovara naslovu cijele serije). Danas o obično zanemarenim skupinama periodnog sustava, umjetnim elementima o kojima ne znamo praktički ništa, te o onome što nas čeka u osmom razdoblju.
, dva reda, obično postavljena ispod ploče, u školi se s omalovažavanjem odnose - učitelj će samo spomenuti njihovo postojanje i prijeći na druge, "važnije" elemente. Potpuno neadekvatni za funkciju koju obavljaju u suvremenom svijetu. Uran i Pluton () čine temelj nuklearne energije: pouzdan izvor u svim klimatskim uvjetima (za razliku od netradicionalne energije), a kada se pravilno koristi, siguran je i ekološki prihvatljiv. Lantanidi su trenutno strateška sirovina potrebna u mnogim naprednim tehnologijama, na primjer, moderna elektronika ne bi postojala bez lantanida. Ali čak i sada, obje je grupe teško razlučiti zbog zakona periodičnosti.
Problem #1: Lantanidi
Mendeljejev poznavao je samo nekoliko lantanida i bez većih poteškoća ih je uspio uvrstiti u tablicu (1). U kasnijim godinama, međutim, otkrića takvih metala dovela su u pitanje sam zakon periodičnosti. Zahtijeva uzastopne elemente koji leže u susjednim skupinama i imaju različite valencije. U međuvremenu, lantanoidi s neznatno različitim atomskim masama (što je značilo da su morali stajati jedan za drugim u neprekidnom nizu) uvijek su imali valenciju jednaku III (neki i II ili IV), odnosno bili su u istoj skupini. Iznesene su mnoge teorije o lantanidi, na primjer, svi su se smatrali istim elementom u različitim verzijama. Problem je riješen stavljanjem lantanoida u jednu "kutiju" sustava, no samo je kvantna mehanika 20-ih i 30-ih godina objasnila njihov položaj u periodnom sustavu.
1. Cerij, najčešći lantanid. Svi ostali lantanidi su slični i izgledaju kao aluminij ()
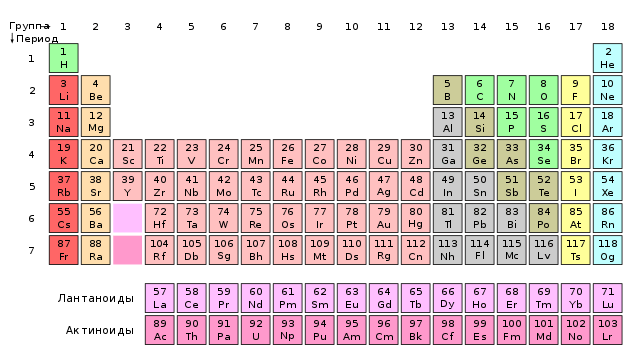
Problem s lantanidima aktualan je i danas. Zapravo, ne zna se kojim elementom počinju i završavaju. Prema većini udžbenika, lantan, iako je dao ime cijeloj obitelji, ne pripada njoj - on je skandalozno za grupu 3lantanidi su metali od cerija do lutecija. Međutim, suprotstavljena mišljenja govore da posljednji član obitelji puno bolje skenira. moliti. Njegova fizikalna svojstva i kemijska priroda nastalih spojeva bolje odgovaraju onima ostalih elemenata 3. skupine (dakle, lantanidi su metali od lantana do iterbija). Rasprave među kemičarima traju i danas, a autori knjiga na različite načine prikazuju položaj ovih elemenata (2).
2. Najduži oblik periodnog sustava. Lantanidi i aktinidi počinju odmah nakon grupe 2, a skandleri uključuju lutecij i laurene.
Problem #2: aktinidi
aktinidi, odnosno elementi od aktinija do Laurencea, čine skupinu sličnu lantanidima, smještenim u sljedeće razdoblje. Problem s aktinidima bio je i ostao isti kao i s lantanidima. Mendeljejev je poznavao samo dva aktinida i bez poteškoća ih je naveo u tablici (3). Humka s najjačom valencijom, IV skupina pripala je skupini titana i cirkonija, a skupina VI s vrijednošću uranijum nalazi u društvu kroma, molibdena i volframa.
Otkrića na prijelazu iz XNUMX. i XNUMX. stoljeća šokirala su sustav: pojavilo se desetak radioaktivnih elemenata. Neki od njih imali su iste mase, ali različita svojstva, dok su drugi imali ista svojstva – različite mase. Ova činjenica bila je u suprotnosti s prethodnim saznanjima, ali otkriće izotopa razjasnilo je neke probleme. Pokazalo se da su većina elemenata mješavine atoma različite mase (ali, naravno, s istim brojem protona u jezgri). Vraćajući se aktinidima, dva su se pojavila početkom prošlog stoljeća. Aktinij se odmah pokazao sličnim lantanu (njegova radioaktivnost pronađena je u sedimentima lantanida precipitiranih iz otopina koje sadrže aktinij), a protaktinij je pao u skupinu s vanadijem, niobijem i tantalom kao V-vrijednim elementom. Sve do 40-ih godina prva četiri aktinida bila su mirno smještena u skupinama od 3 do 6.
3. Najčešći aktinidi: lijevo je torij, prekriven slojem dioksida, desno je uran ()
Problem je nastao tijekom provedbe projekta Manhattan. Fizičari i kemičari bili su sigurni da su proizveli elemenata težih od uranameđutim, nisu bili u mogućnosti otkriti njihovu prisutnost kemijskim sredstvima. Na primjer: element 93 pored urana nije se ponašao kao član grupe 7. To je bila samo sugestija Glena Seaborga, kasnijeg otkrića nekoliko transuranijevih elemenata, da elementi koji počinju s aktinijem formiraju redove slične lantanidima riješili su problem (4 ). Korištenje razvijenih metoda za odvajanje lantanida, uglavnom kromatografije, omogućilo je u narednim godinama identificiranje umjetnih elemenata. O savršenstvu tehnologije i umijeću eksperimentatora svjedoči činjenica da je prisutnost nekih novih elemenata otkrivena sa samo desetak njihovih atoma! (pet).
Ali nemojte vjerovati da su torij ili uran iznenada promijenili svoja svojstva i postali trovalentni metali slični lantanidu. Još uvijek imaju više zajedničkog s titanidima i kromom nego s drugim aktinidima. Slično s protaktinatima, pa čak i nekim transuranistima. O određenoj sličnosti možemo govoriti samo u drugoj polovici serije. Međutim, za lantanoide i aktinide se ne može reći da su srodne obitelji (kao da njihov smještaj u periodnom sustavu sugerira njihovu lokaciju).
4. Glenn Seaborg (1912-99) daje simbol za element nazvan po njemu.
5. Rodno mjesto mnogih transuranista je ciklotron u Nacionalnom laboratoriju Lawrence Berkeley (kolovoz 1939.)
Nema eksperimentalnih podataka
Netočno poznavanje svojstava najtežih transuranida povezano je s nedovoljnom količinom materijala za istraživanje. Posljednji element koji se proizvodi u značajnoj količini miligrama je einstein, koji se nalazi na 99. mjestu na tabeli. Naravno, eksperimenti se provode i s drugim transuranidima, ali se u njihovom slučaju, na primjer, proučava karakteristično zračenje koje nastaje u precipitatu, a ne opaža se stvaranje kristala spojeva.
Fizičko-kemijska svojstva ne može se jednostavno izmjeriti, već samo procijeniti iz neizravnih opažanja. Sličan problem javlja se s dva lakša elementa: astatu (br. 85) i francuski (br. 87). Zbog kratkog vijeka trajanja vidljive veličine još nisu dobivene, a teorija mora popuniti praznine u promatranjima i mjerenjima. S druge strane, godišnja proizvodnja plutonija, koji se nalazi u tragovima u zemljinoj kori, iznosi nekoliko tona i bolje se razumije od mnogih lakših postojanih elemenata.
Još veći problem je s najtežim elementima s periodom od 7 nakon aktinida. U njihovom slučaju, treba raditi s doslovno odvojenim atomima, čiji se životni vijek izračunava u djelićima sekunde. Više nije moguće odrediti radioaktivnost prisutnu u precipitatu spoja vezanog na element, već samo istražiti određena fizikalna svojstva (kao što je brzina taloženja na danoj površini) i tako donijeti zaključke o kemijskoj sličnosti. Naravno, pomaže teorija, točnije izračuni temeljeni na kvantnoj mehanici. Međutim, rezultati nisu 100% pouzdani, primjerice, prema određenoj raspodjeli elektrona na ljuskama, opis kemijskih svojstava još je daleko. Što se više udaljavamo od izravnih podataka promatranja, zaključak "Metode Mendeljejeva" (odnosno na temelju svojstava poznatih elemenata) postaje nepouzdaniji.
Kemičari i fizičari pokušavaju predvidjeti svojstva čak i najtežih, još nedobivenih elemenata sljedećeg razdoblja. Elementi 119 i 120 vjerojatno će imati značajke koje se neće mnogo razlikovati od onih koje se nalaze iznad francija i radija (u skupinama 1 i 2 promjena fizikalno-kemijskih svojstava je sasvim prirodna). U razdoblju 8, poput lantanoida i aktinida, postojat će čak 18 vrlo sličnih svojstava g-blok elemenata s kojima se znanstvenici još nisu bavili.
Proračuni upućuju na postojanje elemenata s valentnošću do 12. Vjerojatno će u sustavu biti element 164, za teže će nuklearni naboj biti toliki da će na njih padati elektroni, a orbitalna brzina bi premašila brzina svjetlosti. Provedeni izračuni ne daju jednoznačne rezultate, neki pomiču granice periodnog sustava za desetak elemenata.
Zakon periodičnosti u smeću?
Nakon što ste pročitali članak, vjerojatno ste došli do toga veliki broj izuzetaka iz pravila koja su data u školi, to vam daje pravo da na pitanje odgovorite potvrdno. Ali nemojte to prebrzo. Zakon periodičnosti formuliran je na vrlo općeniti način (svojstva se periodično ponavljaju), što je njegova prednost i nedostatak. Prednost je, naime, analizom položaja elementa u tablici izgrađenoj na temelju zakona, može se izvući zaključak o njegovim fizikalnim i kemijskim svojstvima. Nedostatak, jer su zaključci često netočni ili čak lažni.
Zakon periodičnosti dobro djeluje u glavnim skupinama (1, 2, 13-18), bolje u gornjim nego u donjim dijelovima. Savršen primjer je razdoblje 3: od natrija do argona, valencija i kemijska svojstva redovito se mijenjaju bez ikakvih iznenađenja. U bočnim skupinama (3-12) već su jasno vidljiva odstupanja, no o problemima s lantanidima i aktinidima čitali ste gore. Općenito, što je dalje od početka sustava, zakon periodičnosti je manje zadovoljen.
Dakle u smeće? Svemir kemijskih elemenata a odnosi koje stvaraju sustav su toliko složen da ga čak ni briljantna ideja Mendeljejeva ne može u potpunosti obuhvatiti. Zakon svakako treba korigirati i pojasniti. Usporedimo li Mendeljejeva s Newtonom (budući da su i zakon periodičnosti i teorija gravitacije organizirali i objasnili velike dijelove svijeta oko nas), možemo zaključiti da kemičari još uvijek čekaju svog Einsteina.
Vidi također:

