Kako radi litij-ionska baterija za električno vozilo?
Nakon što smo u drugom članku vidjeli rad olovne baterije, kojom su opremljeni svi automobili, pogledajmo sada princip rada električnog vozila, a posebno njegove litijeve baterije ...

Princ
Kao i kod svake vrste baterija, princip ostaje isti: naime, generirati energiju (ovdje električnu energiju) kao rezultat kemijske ili čak električne reakcije, jer kemija je uvijek uz električnu energiju. Zapravo, sami atomi su napravljeni od elektriciteta: to su elektroni koji se okreću oko jezgre i koji na neki način tvore "ljusku" atoma, ili čak njegovu "kožu". Znajući također da su slobodni elektroni leteći komadići kože koji provode svoje vrijeme krećući se od jednog atoma do drugog (bez da se vežu za njega), to je samo u slučaju vodljivih materijala (ovisi o broju slojeva elektrona i broju elektrona po zadnjem projektilu).
Zatim uzimamo "komad kože" od atoma (dakle dio njegove struje) kemijskom reakcijom da bismo proizveli električnu energiju.

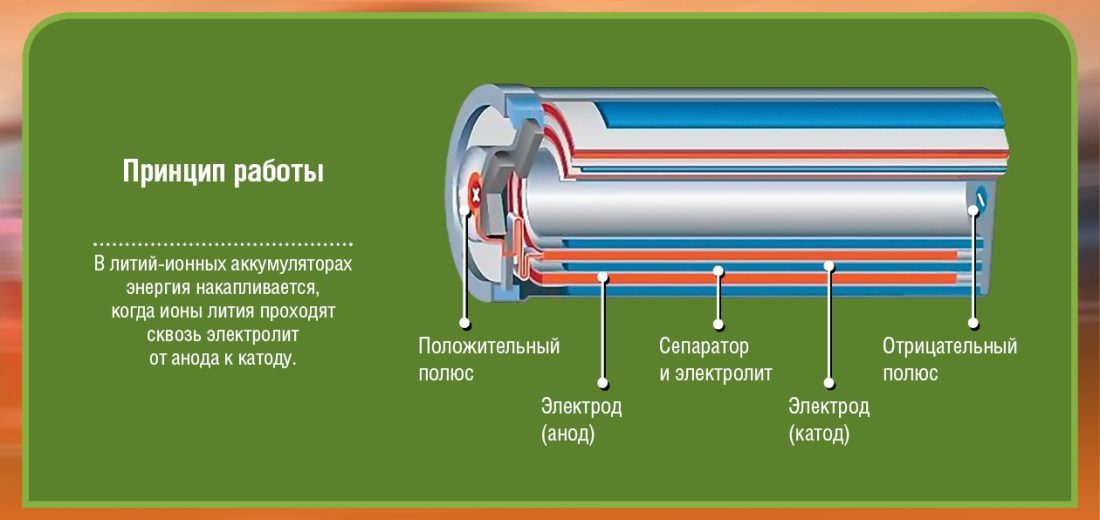
osnove
Prije svega, postoje dva pola (elektrode) koje nazivamo katoda (+ terminal: u litij-kobalt oksidu) i anoda (terminal -: ugljik). Svaki od ovih polova napravljen je od materijala koji ili odbija elektrone (-) ili privlači (+). Sve je poplavljeno elektrolit što će omogućiti kemijsku reakciju (prijenos materijala s anode na katodu) kao rezultat stvaranja električne energije. Između ove dvije elektrode (anode i katode) umetnuta je barijera kako bi se izbjegli kratki spojevi.
Imajte na umu da se baterija sastoji od nekoliko ćelija, od kojih je svaka sastavljena od onoga što je vidljivo na dijagramima. Ako, na primjer, skupim 2 ćelije od 2 volta, imat ću samo 4 volta na izlazu baterije. Da biste pokrenuli automobil težak nekoliko stotina kg, zamislite koliko je ćelija potrebno ...
Što se događa na deponiji?
Desno su atomi litija. Predstavljeni su detaljno, pri čemu žuto srce predstavlja protone, a zeleno srce predstavlja elektrone oko kojih kruže.
Kada je baterija potpuno napunjena, svi atomi litija su na strani anode (-). Ovi atomi se sastoje od jezgre (sastavljene od nekoliko protona), koja ima pozitivnu električnu silu 3, i elektrona, koji imaju negativnu električnu silu od 3 (ukupno 1, jer je 3 X 3 = 1). ... Stoga je atom stabilan s 3 pozitivna i 3 negativna (ne privlači niti odbija elektrone).
Odvajamo elektron od litija, za koji se ispostavi da ima samo dva: tada ga privlači + i prolazi kroz pregradu.
Kada uspostavim kontakt između + i - terminala (dakle, kada koristim bateriju), elektroni će se kretati od - terminala do + terminala duž električne žice izvan baterije. Međutim, ti elektroni dolaze iz "dlake" atoma litija! Uglavnom, od 3 elektrona koji se vrte okolo, 1 je otrgnut i atomu su ostala samo 2. Odjednom, njegova električna sila više nije uravnotežena, što također uzrokuje kemijsku reakciju. Napomenimo također da atom litija postaje litij ion + jer je sada pozitivan (3 - 2 = 1 / jezgra vrijedi 3, a elektroni 2, jer smo izgubili jedan. Zbrajanje daje 1, a ne 0 kao prije. Dakle, više nije neutralno).
Kemijska reakcija koja je posljedica neravnoteže (nakon razbijanja elektrona za stvaranje struje) rezultirat će slanjem litij ion + na katodu (terminal +) kroz zid dizajniran da izolira sve. Na kraju, elektroni i ioni + završavaju na + strani.
Na kraju reakcije, baterija se prazni. Sada postoji ravnoteža između + i - terminala, što sada sprječava struju. U osnovi, princip je inducirati depresiju na kemijskoj/električnoj razini kako bi se stvorila električna struja. O tome možemo razmišljati kao o rijeci, što se više spušta, to će biti važniji intenzitet tekuće vode. S druge strane, ako je rijeka ravna, više neće teći, što znači da je baterija mrtva.
Napuniti?
Ponovno punjenje sastoji se od obrnutog procesa ubrizgavanjem elektrona u određenom smjeru - i uklanjanja više usisavanjem (to je pomalo kao obnavljanje vode u rijeci da bi se ponovno koristio njezin tok). Tako se sve u bateriji vraća kako je bilo prije pražnjenja.
Uglavnom, pri pražnjenju koristimo kemijsku reakciju, a kada se punimo, vraćamo originalne stvari (ali za to vam treba energija pa samim tim i punionica).
Nositi?
Litij baterije se troše brže od dobrih starih olovnih baterija koje se stoljećima koriste u našim automobilima. Elektrolit ima tendenciju razgradnje, kao i elektrode (anoda i katoda), ali treba uzeti u obzir i da se na elektrodama stvara talog koji smanjuje prijenos iona s jedne strane na drugu... Posebni uređaji omogućuju za povrat istrošenih baterija pražnjenjem na poseban način.
Broj mogućih ciklusa (pražnjenje + potpuno punjenje) procjenjuje se na oko 1000-1500, tako da s poluciklusom pri punjenju od 50 do 100% umjesto od 0 do 100%. GRIJANJE također ozbiljno oštećuje litij-ionske baterije, koje se obično zagrijavaju kada troše previše energije.
Vidi također: Kako uštedjeti bateriju u svom električnom automobilu?
Snaga motora i baterija...
Za razliku od termovizira, na snagu ne utječe spremnik goriva. Ako imate motor od 400 KS, onda vam rezervoar od 10 litara neće spriječiti da dobijete 400 KS, čak i ako je to vrlo kratko... Za električno vozilo to uopće nije isto! Ako baterija nije dovoljno snažna, motor neće moći raditi punim kapacitetom... To je slučaj s nekim modelima gdje se motor nikada ne može gurnuti do svoje granice (osim kada se vlasnik petlja i dodaje veliki kalibar baterija!).
Sada doznajmo: kako radi ELEKTROMOTOR
Svi komentari i reakcije
posljednji objavljen komentar:
mao (Datum: 2021., 03:03:15)
vrlo dobar posao
Il J. 1 reakcije na ovaj komentar:
- administrator ADMINISTRATOR MJESTA (2021-03-03 17:03:50): Ovaj komentar je još bolji 😉
(Vaš će post biti vidljiv ispod komentara nakon potvrde)
Napiši komentar
Što mislite o podacima o potrošnji koje su naveli proizvođači?
